Introduction
Présentation des Haploops et de leur habitat benthique particulier
Les Haploops sont des crustacés marins amphipodes de la classe des Malacostracés, de la famille des Ampélicidés qui représentent 32 espèces (World Register of Marine Species WoRMS, photo 1). Ces organismes sont présents dans les fonds marins à des profondeurs allant de 10 à 30 mètres (Ifremer, 2011). Ils forment des peuplements très denses, jusqu’à 25 000 individus/m2, appelés des « banquettes ». Les Haploops sont des espèces ingénieures tubicoles qui construisent leur habitat en forme de tube (photo 2) à partir d’un mélange de particules captées dans le milieu (sables fins, sédiments vaseux), de pseudofèces (particules non digérées par l’animal) et de mucus constitué de polysaccharides qu’ils produisent eux-mêmes (Jones et al., 1994 ; Rigolet, 2013). Les Haploops passent la majeure partie de leur vie sur le dos au niveau de l’ouverture de leur tube. Ils sont des organismes suspensivores stricts qui se nourrissent de microalgues et de phytoplanctons en suspension. Ils les filtrent à l’aide de leurs deux paires d’antennes qui balayent la colonne d’eau (Rigolet et al., 2011). Les Haploops sont des organismes sémelpares qui sortent définitivement de leur tube lorsqu’ils atteignent leur maturité sexuelle. Ils se reproduisent généralement à l’âge de 2 à 3 ans.
Localisation des colonies de Haploops
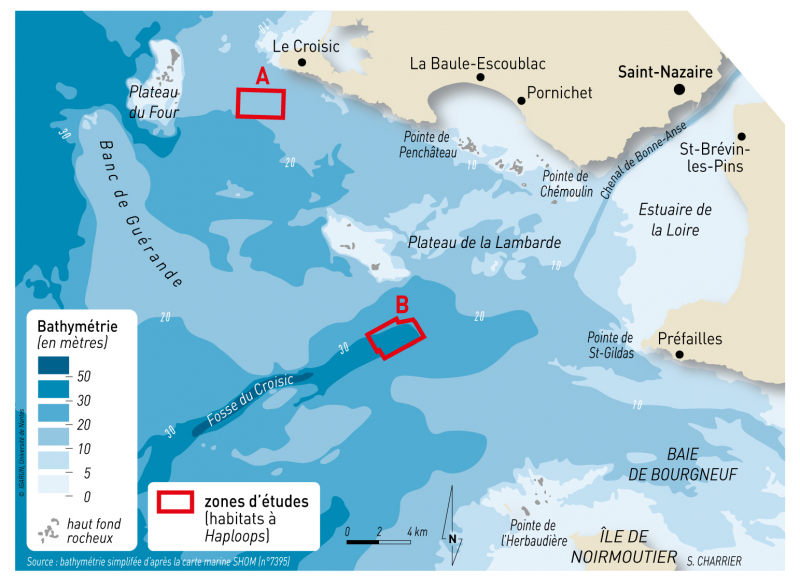
Les Haploops ont été cartographiés dans plusieurs secteurs benthiques comme en Suède, au Danemark et également en France, à Concarneau. Champilou et al. (2019) ont mis en évidence la présence des Haploops dans la partie marine à l’embouchure de l’estuaire de la Loire, dans les zones de La Lambarde et du Croisic (fig. 1). Au niveau de la Lambarde et du Croisic, les tapis s’étendent sur 4 et 6 km² respectivement. Baltzer et al., (2020.) montrent également que les deux zones d’habitat à Haploops près de l’estuaire de la Loire progressent spatialement, sur des superficies d’environ 1 km2 par an.
Figure 1 - Localisation des zones d’études dans la partie maritime de l’estuaire de la Loire : étendues des habitats à Haploops dans les zones de la Lambarde (A) et du Croisic (B)
Enjeux liés à la présence des tapis de Haploops
Comme cela a été explicité plus haut, les Haploops sont grégaires et vivent en colonies très denses. D’après les références bibliographiques (Glémarec et al. 1987), leur implantation nécessite un environnement constitué de vases sableuses consolidées telles que celles décrites par Vanney (1964), et l’édification de leurs habitats permet d’augmenter significativement le piégeage des sédiments fins et des particules en suspension dans les masses d’eau. Leur positionnement à l’embouchure de l’estuaire de la Loire laisse supposer que ces habitats sont susceptibles de capter et retenir des contaminants divers. Les tubes pourraient être construits à partir de particules d’origine naturelle (matières organiques particulaires, argiles) mais aussi d’origine anthropique (microplastiques). De plus, en considérant que les particules en suspension et les sédiments fins constituent le substrat d’adsorption préférentiel des contaminants organiques hydrophobes et de certains éléments métalliques, ces habitats particuliers pourraient constituer une zone d’accumulation préférentielle, voire de piégeage sélectif.
L’objectif principal d’une future étude sera de déterminer le pouvoir de rétention des tapis de Haploops en contaminants organiques, en métaux et en microplastiques.
Les Haploops ayant été peu étudiés et afin de tenter de répondre partiellement à la question scientifique de la rétention des contaminants par l’habitat benthique à Haploops, une étude bibliographique a été menée. Celle-ci s’est focalisée sur la capacité de bioaccumulation d’organismes benthiques et intertidaux en contaminants organiques, métalliques et microplastiques. Les articles scientifiques choisis pour réaliser cette étude portent sur des organismes marins possédant des caractéristiques proches de celles des Haploops en termes de mode de nutrition par filtration, de formation de colonies denses, d’habitat benthique, de profondeur à laquelle ils vivent.
Les contaminants du milieu marin
Généralités
Chaque année plus de 20 milliards de tonnes de déchets et autres contaminants sont rejetés dans le milieu marin (Planetoscope, 2020). Ils atteignent les côtes et proviennent essentiellement des activités anthropiques qui représentent 80 % de la pollution marine (UNESCO, 2017). En effet, l’industrialisation et l’urbanisation, en s’intensifiant sur les côtes, ont entraîné la présence de fortes quantités de déchets contaminés et rejetés dans les écosystèmes marins côtiers (Hwang et al., 2016 ; Lee et al., 2019). Par exemple, les habitats marins sont contaminés par des débris, notamment plastiques, des contaminants organiques (Hydrocarbures Aromatiques Polycycliques HAP, Polychlorobiphényles PCB, pesticides organochlorés…) et inorganiques (éléments traces métalliques) (Goeury, 2014 ; UNESCO, 2017).
Une fois dans l’environnement marin, certains éléments traces métalliques, contaminants organiques (HAP, PCB, pesticides organochlorés) et les microplastiques sont susceptibles de s’accumulent dans le milieu abiotique : eau et sédiments (NOAA, 2019). Les organismes sont alors exposés aux contaminants qui y sont présents. Ces derniers peuvent passer les barrières biologiques en fonction de leur biodisponibilité et imprégner les organismes marins. Les débris peuvent provoquer un stress physique aux organismes, en les blessant ou en obstruant leur système digestif, ce qui peut leur être létal. Quant aux contaminants organiques et inorganiques, ils peuvent atteindre les seuils de toxicité chronique pour les organismes menant à des atteintes à différents niveaux d’intégration biologique (génotoxicité, neurotoxicité, immunotoxicité, reprotoxicité, stress oxydatif) (Lee et al., 2019 ; Benadda, 2019).
Les métaux
Les métaux sont des éléments de la classification périodique dont les sources naturelles incluent les volcans et l’altération de minéraux primaires. Leur distribution dans le milieu peut varier également du fait des activités humaines (industries, urbanisation, agriculture). En effet, ils sont utilisés depuis longtemps pour leurs propriétés physico-chimiques comme par exemple une résistance mécanique, une conductivité thermique ou électrique, voire des propriétés biocides (Mason, 2013 ; Chouvelon et al., 2017).
Dans les écosystèmes marins, certains métaux, appelés oligoéléments, tels que le cuivre (Cu), le fer (Fe), le zinc (Zn), sont retrouvés à des concentrations entre le picogramme et le microgramme par litre. Ces oligoéléments sont indispensables au bon développement des organismes. Cependant, depuis quelques années, les concentrations de ces métaux ont augmenté de manière significative dans l’environnement marin, et sont devenues supérieures aux concentrations naturelles. D’autres métaux comme le mercure (Hg), le chrome (Cr) et le plomb (Pb), sont considérés comme toxiques pour les organismes vivants, même à faibles concentrations (Lee et al., 2019).
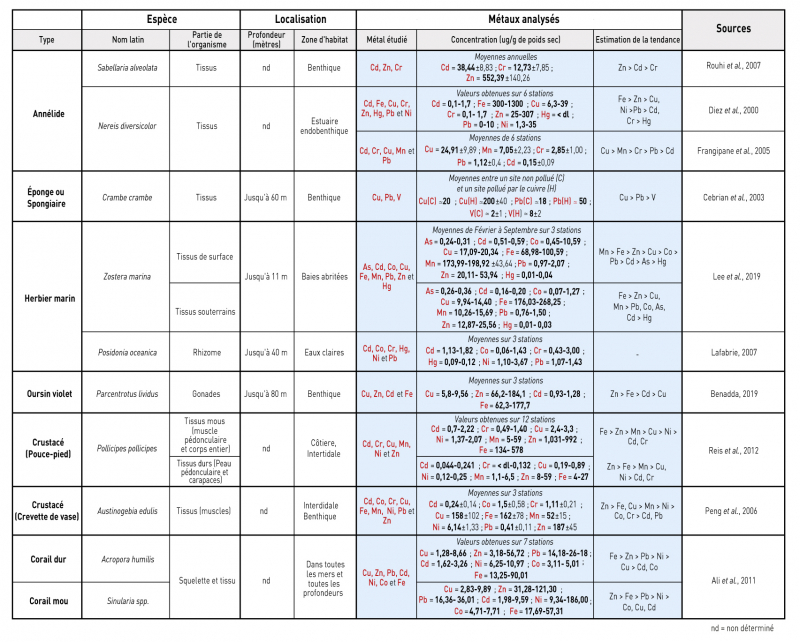
Plusieurs études (tab. 1) rapportent des teneurs en métaux dans les tissus de plusieurs organismes benthiques. Plusieurs embranchements du règne animal marin sont représentés tels que les annélides (Sabellaria alveolata, Nereis diversicolor), les crustacés (Pollicipes pollicipes), les éponges (Crambe crambe), les oursins (Paracentrotus lividus), la crevette (Austinogebia edulis) et les coraux (Acropora humilis et Sinularia sp.). Dans le tableau 1 sont également présentés des espèces marines du règne végétal, telles que les herbiers marins (Zostera marina et Posidonia oceanica) qui forment des colonies très denses et qui sont retrouvées dans les eaux claires et les baies abritées des zones côtières.
Les résultats répertoriés dans le tableau 1 montrent que pour la plupart de ces organismes de nombreux métaux sont bioaccumulés dans les tissus avec des teneurs allant de 4 à 1 300, de 1 à 992, de 1 à 199 et 0,19 à 158 µg/g de poids sec pour Fe, Zn, Mn, Cu respectivement. Ces éléments sont des oligoéléments, ce qui explique qu’ils sont retrouvés en concentrations importantes dans les tissus des organismes marins comparées à celles des autres métaux (Benadda, 2019 ; Peng et al., 2006). En effet, Pb et Cd présentent des teneurs bien en-deçà des teneurs des oligoéléments avec des valeurs respectives atteignant 36 et 9,29 µg/g de poids sec pour les coraux et 18 µg/g de poids sec de Pb pour les éponges. Ils ne sont pas détectés dans les autres organismes étudiés. Enfin, les autres métaux (Co, Hg et Cr) sont très peu concentrés dans les tissus de ces organismes marins (<12 µg/g en poids sec).
Les contaminants organiques
Certaines familles de contaminants organiques font partie des polluants organiques persistants (POP), listés dans la Convention de Stockholm, accord international ayant pour but de réduire ou éliminer leur rejet dans l’environnement. Cette liste comprend notamment les polychlorobiphényles (PCB) issus de produits chimiques industriels, certains pesticides comme le dichlorodiphényltrichloroéthane (DDT), le dichlorodiphenyldichloroéthane (DDD), l’hexachlorobenzène (HCB) et le lindane (gamma-hexachlorocyclohexane : γ-HCH). Des composés de dégradation du lindane (α-HCH) et du DDT, le dichlorodiphényldichloroéthylène (DDE) sont également souvent recherchés dans le milieu naturel du fait de leur persistance et de leur toxicité. Au niveau européen, la directive-cadre sur l’eau (DCE) a également établi une liste évolutive des contaminants prioritaires à suivre dans l’environnement dans un but de surveillance de la qualité chimique des milieux. Les Hydrocarbures Aromatiques Polycycliques (HAP) font partie de cette liste. Ce sont des composés organiques d’origine naturelle (feu de forêt, activité volcanique) ou anthropique (pyrogène ou pétrogène) (Couderc et al., 2015 ; Couderc et al., 2016). Le caractère persistant, bioaccumulable ou encore toxique des contaminants organiques évoqués représentent un danger pour l’environnement. Leur omniprésence dans l’environnement, notamment à cause de rejets anthropiques, est considérée comme une menace mondiale pour les écosystèmes (European Commission, 2013 ; Couderc et al., 2016 ; Benadda, 2019 ; Das et al., 2020).
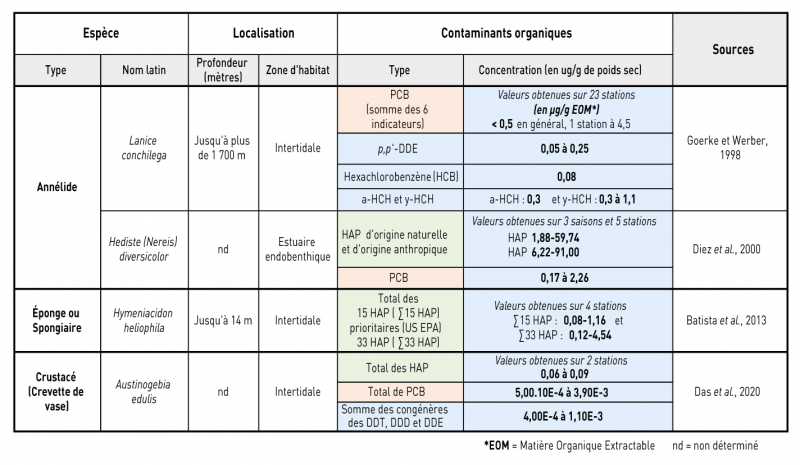
Les études concernant les contaminants organiques sont regroupées dans le tableau 2. Elles portent sur les teneurs en HAP, PCB et/ou de divers pesticides organochlorés et sous-produits de dégradation (DDE, HCB, HCH et DDT) chez des espèces aquatiques marines telles que des annélides (L. conchilega et H. diversicolor), des éponges (H. heliophila) et des crevettes (A. edulis).
Tableau 2 - Teneurs en contaminants organiques mesurées dans les tissus de plusieurs organismes benthiques
En fonction de l’abondance de certains HAP, il est possible d’en déduire leur origine naturelle ou anthropique. De ce fait, il a été montré que les annélides H. diversicolor semblent bioaccumuler de manière plus importante les HAP d’origine anthropique plutôt que ceux d’origine naturelle, atteignant des valeurs allant de 0,06 à 91 µg/g de poids sec (Das et al., 2020 ; Diez et al., 2000). La même constatation a été observée chez les éponges H. heliophila. L’analyse des tissus spongieux a montré que ces éponges accumulent de manière plus efficace les HAP anthropiques, notamment d’origines pétrogène et pyrolytique (Batista et al., 2013).
Concernant les PCB et les pesticides organochlorés, il semblerait que de manière générale leur concentration dans les organismes marins soient relativement faible, avec des valeurs allant de 5.10-4 à 2,26 µg/g en poids sec pour les PCB.
Les microplastiques
Les principaux plastiques synthétiques sont le polyéthylène (PE ; basse densité LDPE ; haute densité HDPE), le polypropylène (PP), le polystyrène (PS), le polyéthylène téréphtalate (PET), le chlorure de polyvinyle (PVC). Ils constituent 90 % de la production mondiale de plastique. De récentes études évaluent la quantité totale de plastique produite depuis son invention à 8,3 milliards de tonnes (Geyer et al., 2017). Sur ce total, près de 9 % auraient été recyclés (Geyer et al., 2017), alors que la quantité de plastique qui pénètre dans l’océan chaque année est estimée entre 4,8 et 12,7 millions de tonnes (Jambeck et al., 2015). Au niveau mondial, les meilleures estimations suggèrent qu’environ 80 % des plastiques océaniques proviennent de sources terrestres, et les 20 % restants de sources marines (Li et al., 2016).
Une fois parvenus dans l’océan, ces déchets plastiques sont entraînés par les courants marins. Ces courants marins forment d’immenses vortex appelés gyres océaniques dans lesquelles les déchets vont s’accumuler. La notion de septième continent est évoquée même s’il existe cinq zones d’accumulations au niveau du globe : une dans le Pacifique Nord, une dans le Sud, une dans l’Atlantique Nord et une dans le Sud et une dans l’océan Indien.
Durant leur voyage qui peut durer jusqu’à 10 ans, les plastiques vont subir une dégradation progressive due à la photodégradation ou à la biodégradation. Les plastiques vont donc être fragmentés et former ce que l’on appelle des microplastiques définis comme des microparticules de plastique d’un diamètre inférieur à 5 mm (Duis and Coors, 2016). Les microplastiques ainsi issus de la fragmentation de macrodéchets sont qualifiés de secondaires, à l’instar des microplastiques primaires volontairement utilisés sous une taille micrométrique dans divers produits du quotidien (encres, produits ménagers, de soin, maquillages). Dans l’environnement aquatique, les microplastiques peuvent flotter ou couler en fonction de leur densité. La taille des particules, l’altération de la matière plastique ou encore l’adsorption de microorganismes ou de matières organiques à la surface des microplastiques peuvent venir modifier la densité. Ainsi, des particules constituées initialement de plastique plus dense que l’eau peuvent se retrouver en surface et ceux moins denses couler dans les fonds marins. La flottaison permet aux microplastiques de se disperser sur de très grandes distances au gré des courants pour finalement s’accumuler dans les gyres. Deux études de Eriksen et al. (2014) et Van Sebille et al. (2015) estiment qu’entre 93 et 268 milliers de tonnes de ces microplastiques flottent actuellement dans les océans. Ceux qui coulent s’accumulent probablement sur le plancher océanique, ce qui entraîne des quantités significatives de microplastiques dans les fonds marins (Woodall et al., 2014).
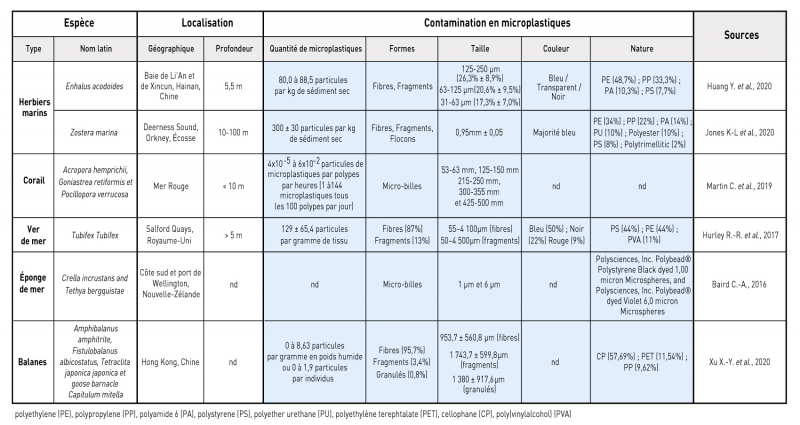
Des études répertoriées dans le tableau 3 ont montré une accumulation de microplastiques par certaines espèces du règne animal comme les coraux (Acropora hemprichii, Goniastrea retiformis et Pocillopora verrucosa), les vers (Tubifex Tubifex), les balanes (Amphibalanus amphitrite, Fistulobalanus albicostatus, Tetraclita japonica japonica, et goose barnacle Capitulum mitella) et les éponges de mer (Crella incrustans et Tethya bergquistae). Des espèces du monde végétal sont également capables d’accumuler des microplastiques comme les herbiers marins (Zostera marina, Enhalus acoroides) qui s’étendent sur de grandes surfaces et régulent l’hydrodynamisme.
Tableau 3 - Données quantitatives et qualitatives des microplastiques issus de plusieurs organismes benthiques
L’accumulation des microplastiques par ces organismes animaux et végétaux peut se faire selon différents processus. Les microplastiques peuvent pénétrer dans l’organisme comme c’est le cas pour les organismes filtreurs par exemple (Xu et al., 2020). Ils peuvent également adhérer à la surface des organismes vivant par un processus passif comme cela a été rapporté par Martin et al. (2019). Dans cette étude il a été montré que les microplastiques ont été piégés par le biofilm présent à la surface des feuilles de l’herbier de Z. Marina (Jones et al., 2020). Enfin, la présence des habitats de certains organismes peut agir comme des pièges mécaniques aux particules en suspension dans l’eau, et notamment aux microplastiques comme cela a été montré dans l’étude de Jones et al. (2020) et de Huang et al. (2020). Une quantité significativement plus importante de microplastiques a été mesurée dans les sédiments du lit des herbiers comparés aux sédiments sableux nus adjacents aux herbiers. Le nombre moyen de microplastiques par kilogramme de sédiments (poids sec) a été enregistré comme étant de 300 ± 30 particules dans les sédiments du site végétalisé et de 110 ± 20 particules dans les sédiments témoins. Les herbiers marins ont alors été caractérisés de puits (Jones et al., 2020 ; Huang et al., 2020). Hansen and Reidenbach (2017) ont démontré que l’interaction du flux d’eau avec les feuilles des herbiers marins provoque une réduction de la turbulence. Leur capacité à atténuer l’énergie du courant marin est due à l’étendue et à la densité de la population d’herbiers marins (Bradley and Houser, 2009). Les herbiers marins vont donc ralentir la vitesse à laquelle les particules en suspension dans la colonne d’eau traversent l’herbier, ce qui engendre une accélération du processus de sédimentation (van Montfrans et al., 1984) donc de l’accumulation de ces contaminants. De plus, la dynamique des sédiments dans un herbier marin peut bloquer le flux d’eau, limitant ainsi les possibilités de remise en suspension des particules capturés dans l’herbier (Jones et al., 2020).
D’après le tableau 3, la quantité de microplastiques retrouvées dans les sédiments dans les zones végétalisées varie en fonction de la localisation géographique, allant de 80 à 884 particules de microplastiques par kg de sédiment sec. Concernant la bioaccumulation, les quantités retrouvées varient en fonction de l’espèce, allant de 1 à 144 microplastiques tous les 100 polypes par jour chez les coraux ou 129 ± 65,4 particules par gramme de tissus chez les vers par exemple.
Les résultats présentés dans le tableau 3 montrent aussi une grande variété des microplastiques accumulés par les organismes à différents niveaux :
- leur taille allant de 1 µm à 3,95 mm ;
- leur forme qui peut être des fibres, des fragments, des flocons, des granulés ;
- et le type de plastique (Polyethylene (PE), Polypropylene (PP), Polyamide 6 (PA), Polystyrene (PS), Polyether urethane (PU), Polyester, Polytrimellitic, Polyethylène Terephtalate (PET) ; Cellophane (CP) ; Poly(vinylalchol) (PVA)).
Parallèle avec les Haploops
Comme cela vient d’être présenté, certains organismes (annélides, éponges, coraux) ayant des caractéristiques communes aux Haploops possèdent la capacité d’accumuler des contaminants organiques, inorganiques et des microplastiques suivant différents processus. Le passage des contaminants dans l’organisme mène à leur bioaccumulation. Ils peuvent également adhérer à la surface des organismes ou encore être piégés mécaniquement (fig. 2). Les teneurs en contaminants relevées dans les tissus, à la surface ou à proximité des organismes sont variables et dépendent :
- de la contamination du milieu lui-même ;
- des caractéristiques abiotiques du milieu (pH, conditions redox, composition minéralogique et organique des sédiments…) ;
- du type de contaminant et ses caractéristiques physico-chimiques (polarité, lipophile, réactivité chimique) ;
- de l’espèce considérée qui possèdent ses propres barrières biologiques, son mode de nutrition et ses moyens de détoxication.
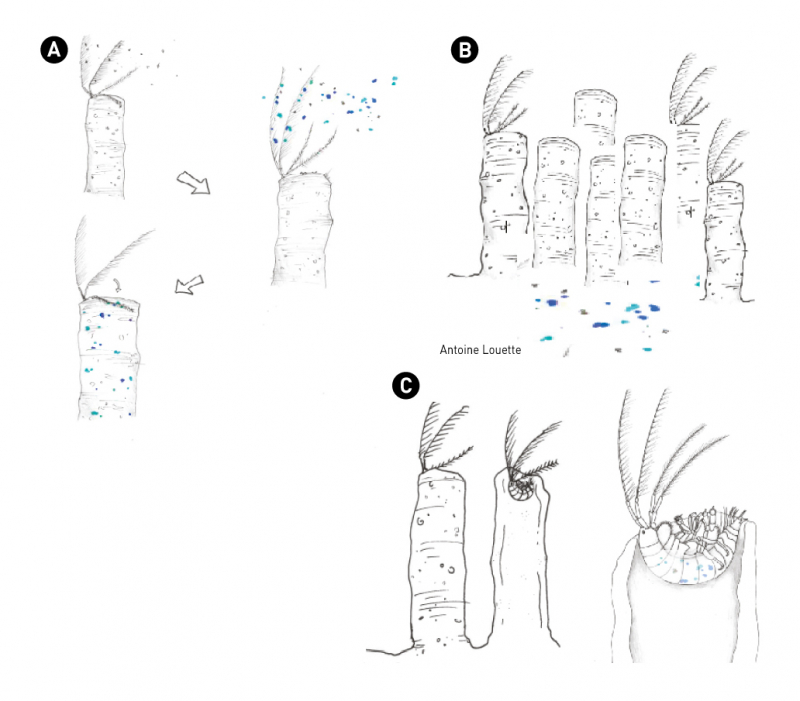
Figure 2 - Dessins représentant les processus hypothétiques de rétention des microplastiques par les Haploops
A) Utilisation pour la construction du tube,
Malgré les facteurs impliqués dans la variabilité d’accumulation des contaminants par les organismes marins présentés ci-dessus, il est possible d’émettre l’hypothèse que les Haploops soient capables de former des zones d’accumulation des contaminants, même si cela n’a pas encore été démontré expérimentalement. En effet, ce sont des organismes filtreurs au même titre que les annélides S. alveolata qui présentent par exemple des teneurs en Zn de l’ordre de 550 µg/g en poids sec. De plus, ils constituent des colonies très denses, atteignant plus de 25 000 individus au km², ce qui entraîne une augmentation de l’accumulation des particules fines (+30 % entre 2017 et 2018) (Champilou et al., 2020) potentiellement chargées en contaminants. Les tapis de Haploops pourraient donc agir comme des paillassons des fonds marins comme c’est le cas des herbiers de zostères où l’on peut y retrouver une certaine quantité de microplastique (300 ± 30 particules de microplastique par kg de sédiment sec sur les sites végétalisés). Enfin, cette espèce ingénieure (tubicole) construit son tube à partir de particules en suspension ce qui pourrait également engendrer une accumulation des contaminants, processus de rétention non illustré dans la littérature. Les particules en suspension utilisées pour la construction des habitats à Haploops peuvent être d’origine naturelle, tout comme anthropique (microplastiques) et ayant absorbé des composés variés inorganiques, comme organiques avec une forte affinité pour les matières organiques.
Conclusion
Les Haploops sont des organismes qui constituent des « tapis » de tubes de plusieurs kilomètres carrés, très denses, capables de piéger les particules fines et d’augmenter leur taux de sédimentation de 30 %. Ces habitats spécifiques ont été répertoriés en Bretagne Sud, dans la Baie de Concarneau et à la sortie des estuaires de la Vilaine et de la Loire. Sachant que certains contaminants se fixent préférentiellement sur les sédiments fins, ces « tapis de Haploops » pourraient avoir une capacité de rétention des contaminants particulièrement efficace, et ceci de trois manières possibles : l’accumulation des particules contaminées dans les tubes eux-mêmes, l’accumulation des contaminants par l’effet « paillasson » des tapis, la bioaccumulation des particules contaminées dans les organismes des Haploops. Si tel est le cas, il serait donc nécessaire de préserver les Haploops et leurs habitats car ils constituent potentiellement un filtre naturel, limitant l’apport des contaminants et polluants d’origine anthropique directement dans l’océan ouvert.